ELEMENTOS Y COMPUESTOS
Tablas periódicas curiosas:
Tabla periódica con forma circular
Tabla periódica con los elementos y el lugar donde los descubrieron
Curiosidades de la tabla periódica:
-Actualmente está compuesta por 118 elementos
-Contiene una gran variedad de nombres y orígenes muy diversos
-Solo tres han sido descubiertos por investigadores españoles
- Andrés Manuel del Río, descubridor del vanadio.
Historia del Rubidio:
El rubidio es un elemento químico de la tabla periódica cuyo símbolo es el Rb y su número atómico es 37,pertenece a los alcalinos.Fue descubierto en 1861 por Robert Bunsen y Gustav Kirchhoff en la lepidolita, es un mineral del grupo de las micas, utilizando un espectroscopio , al detectar las dos rayas rojas características del espectro de emisión de este elemento y que son la razón de su nombre. Son pocas las aplicaciones industriales de este elemento que en 1920 empezó a usarse en células fotoeléctricas habiéndose usado sobre todo en actividades de investigación y desarrollo, especialmente en aplicaciones químicas y electrónicas.
Propiedad de los metales.
-Poseen bajo potencial de ionización y alto peso específico.
-Por regla general, en su último nivel de energía tienen de 1 a 3 electrones.
-Son sólidos a excepción del mercurio (Hg), galio (Ga), cesio (Cs) y francio (Fr), que son líquidos.
-Presentan aspecto y brillo metálicos.
-Son buenos conductores del calor y la electricidad.
-Son dúctiles y maleables, algunos son tenaces, otros blandos.
-Se oxidan por pérdida de electrones.
-Su molécula está formada por un solo átomo, su estructura cristalina al unirse con el oxígeno forma óxidos y éstos al reaccionar con el agua forman hidróxidos.
-Los elementos alcalinos son los más activos.
Propiedades generales de los no-metales.
-Tienen tendencia a ganar electrones.
-Poseen alto potencial de ionización y bajo peso específico.
-Por regla general, en su último nivel de energía tienen de 4 a 7 electrones.
-Se presentan en los tres estados físicos de agregación.
-No poseen aspecto ni brillo metálico.
-Son malos conductores de calor y la electricidad.
-No son dúctiles, ni maleables, ni tenaces.
-Se reducen por ganancia de electrones.
-Sus moléculas están formadas por dos o más átomos.
-Al unirse con el oxígeno forman anhídridos y éstos al reaccionar con el agua, forman oxiácidos.
-Los halógenos y el oxígeno son los más activos.
-Varios no-metales presentan alotropía (elementos que poseen estructuras químicas diferentes).
Enlaces Químicos
o distintos. Cuando los átomos se unen se dice que forman enlaces. La fuerza con la que se unen los átomos depende del tipo o naturaleza de los átomos que se unen. Hay átomos que se atraen entre sí con mucha fuerza y se unen muy fuertemente y otros que prácticamente no se atraen nada y no se unen.
Enlace metalico
Se produce cuando se unen átomos de un mismo metal, produciéndose estructuras muy compactas formando redes tridimensionales.
Las sustancias metálicas tienen propiedades muy características, como el brillo y la conductividad eléctrica, de aquí se deduce que los electrones implicados en este tipo de enlace deben tener gran libertad de movimiento.
Los átomos de los metales tienen pocos electrones en su última capa, por lo general 1, 2 ó 3. Éstos átomos pierden fácilmente esos electrones y se convierten en iones positivos.
Teoría de bandas:
Esta teoría representa un modelo más elaborado para explicar la formación del enlace metálico; se basa en la teoría de los orbitales moleculares. Esta teoría mantiene que cuando dos átomos enlazan, los orbitales de la capa de valencia se combinan para formar dos orbitales nuevos que pertenecen a toda la molécula, uno que se denomina enlazante (de menor energía) y otro antienlazante (de mayor energía).

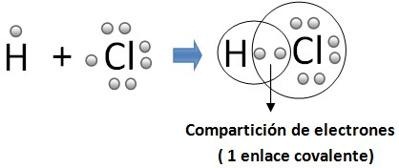
Enlace covalente
Los enlaces covalentes son las fuerzas que mantienen unidos
entre sí los átomos no metálicos (los elementos situados a la derecha en la
tabla periódica -C, O, F, Cl, ...).
Estos átomos tienen muchos electrones en su nivel más
externo (electrones de valencia) y tienen tendencia a ganar electrones más que
a cederlos, para adquirir la estabilidad de la estructura electrónica de gas
noble. Por tanto, los átomos no metálicos no pueden cederse electrones entre sí
para formar iones de signo opuesto. Un compuesto donde sólo hay enlaces
covalentes (y no intermoleculares) está formado únicamente por átomos y se
denomina ATÓMICO o COVALENTE. Las fórmulas de estos compuestos son empíricas:
representan la proporción de átomos en la red. Por ejemplo la fórmula SiO2 representa
que hay doble número de átomos de oxígeno que de átomos de silicio.

Enlace iónico
Este enlace se produce cuando átomos de elementos metálicos (
En este caso los átomos del metal ceden electrones a los átomos del no metal, transformándose eniones positivos y negativos, respectivamente. Al formarse iones de carga opuesta éstos se atraen por fuerzas eléctricas intensas, quedando fuertemente unidos y dando lugar a un compuesto iónico. Estas fuerzas eléctricas las llamamos enlaces iónicos.
propiedades
..
En este caso los átomos del metal ceden electrones a los átomos del no metal, transformándose eniones positivos y negativos, respectivamente. Al formarse iones de carga opuesta éstos se atraen por fuerzas eléctricas intensas, quedando fuertemente unidos y dando lugar a un compuesto iónico. Estas fuerzas eléctricas las llamamos enlaces iónicos.
propiedades
..
- Son sólidos con elevados puntos de fusión.
- Son solubles en disolventes polares (agua). Sin embargo, presentan baja solubilidad en disolventes apolares.
- Fundidos y en disolución acuosa conducen la corriente electrica.
- Se obtienen a partir de elementos con distinta electronegatividad (metal y nometal)
Los compuestos covalentes presentan las siguientes propiedades:
- Muchos compuestos covalententes son gases y líquidos. Los sólidos presentan puntos de fusión relativamente bajos.
- Presentan una importante solubilidad en disolvente apolares (tolueno, hexano, tetracloruro de carbono). Presentando baja solubilidad en disoventes polares.
- No presentan conductividad electrica en fase líquida.
- Están formados por elementos con electronegatividades similares.

